Catalyseur
En chimie, un catalyseur est une substance qui augmente ou ralentit la vitesse d'une réaction chimique ; il participe à la réaction mais est régénéré à la fin de la réaction.
Recherche sur Google Images :

Source image : forum-auto.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- Qui provoque une catalyse; Qui est assimilé à un catalyseur; Agent de la catalyse. Élément favorisateur, ou alors indispensable, à une réaction... (source : fr.wiktionary)
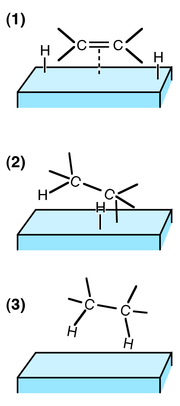
(1) Les réactifs ont sont adsorbés sur la surface du catalyseur et H2 est dissocié.
(2) Un atome H se lie à l'un des atomes C. L'autre atome C est attaché à à la surface.
(3) Un deuxième atome C se lie à un atome H. La molécule s'éloigne de la surface.
En chimie, un catalyseur est une substance qui augmente ou ralentit la vitesse d'une réaction chimique ; il participe à la réaction mais est régénéré à la fin de la réaction. Il ne fait par conséquent partie ni des réactifs ni des produits dans l'équation. Quand un catalyseur est utilisé pour accélérer une transformation, on dit que celle-ci est catalysée. Les catalyseurs agissent uniquement sur des produits déterminés. Si un catalyseur accélère la réaction, il est dit positif; S'il la ralentit, il est dit négatif[1].
Les catalyseurs sont beaucoup utilisés dans l'industrie et en laboratoire parce qu'ils augmentent énormément la production des produits tout en minimisant les coûts de production. Dans la nature et en biochimie, certaines protéines possèdent une activité catalytique. Ils s'agit des enzymes.
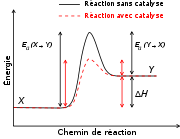
Le catalyseur augmente la vitesse de réaction en introduisant de nouveaux chemins de réaction (mécanisme), et en abaissant son énergie d'activation, ou énergie libre de Gibbs d'activation. Ce faisant il permet d'augmenter la vitesse, ou d'abaisser la température de la réaction. Le catalyseur ne modifie pas l'énergie libre de Gibbs totale de la réaction qui est une fonction d'état du dispositif et n'a par conséquent aucun effet sur la constante d'équilibre.
En plus de modifier la vitesse de réaction, le choix d'un catalyseur peut reposer sur d'autres paramètres :
- la sélectivité : un catalyseur sélectif va faciliter la production du produit désiré comparé aux produits secondaires. A titre d'exemple, lorsque on utilise l'argent métallique pour catalyser la réaction de formation de l'oxyde d'éthylène, à partir d'oxygène et d'éthylène, cette réaction est accompagnée par la formation plus favorable thermodynamiquement de CO2 et H2O ;
- la durée de vie : le catalyseur doit pouvoir demeurer intact après plusieurs cycles de réaction.
Les catalyseurs sont classés selon leur type :
La meilleure ressemblance pour bien comprendre ce qu'est un catalyseur est le moteur à explosion. Un moteur à explosion sans huile ne peut pas fonctionner rapidement. Mais s'il est bien lubrifié, il peut aisément tourner à haut régime. Dans les 2 cas c'est toujours la même réaction : combustion d'un mélange air/essence, l'huile intervient seulement sur la partie mécanique et elle n'est pas consommée lors du fonctionnement du moteur.
C'est précisément la définition d'un catalyseur, composé qui augmente la vitesse de réaction, qui ne change pas l'équation bilan et qui n'est pas consommé lors de la réaction.
La cendre peut servir de catalyseur lors de la combustion du sucre. Le sucre, chauffé au briquet, ne produit aucune flamme. Recouvert de cendre, il peut s'enflammer et brûle d'une flamme bleue.
- Lexique de chimie, Physique et chimie au lycée
- La Chimie au Lycée / la catalyse / généralités sur les catalyseurs, La Chimie au lycée
- ↑ (en) Association québécoise des utilisateurs de l'ordinateur au primaire-secondaire, «Facteurs qui influencent la vitesse d'une réaction», 2005, Association québécoise des utilisateurs de l'ordinateur au primaire-secondaire. Consulté le 31 mars 2009
- Geneviève Wrobel er Louis Ponsolle, Évolution de catalyseurs solides, Éducation nationale (film pédagogique ancien)
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité