Pyrimidine
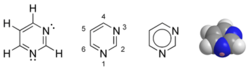
La pyrimidine est une molécule azotée hétérocyclique aromatique voisine de la pyridine et comportant deux atomes d'azote.
| Pyrimidine | |||
|---|---|---|---|
 |
|||
| Structure de la pyrimidine | |||
| Général | |||
| Nom IUPAC | Pyrimidine | ||
| Synonymes | 1, 3-diazine | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES |
|
||
| InChI |
|
||
| Propriétés chimiques | |||
| Formule brute | C4H4N2 [Isomères] |
||
| Masse molaire | 80, 088 g∙mol-1 C 59, 99 %, H 5, 03 %, N 34, 98 %, 80.08796 |
||
| pKa | 1, 2 | ||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Produit non contrôlé | |||
|
|
|||
La pyrimidine (ou 1, 3-diazine) est une molécule azotée hétérocyclique aromatique (C4H4N2) voisine de la pyridine et comportant deux atomes d'azote. Elle est aussi
Dans l'ADN ces bases forment des liaisons hydrogènes avec leurs purines complémentaires :
| purine | pyrimidine |
|---|---|
| A | T |
| G | C |
Dans l'ARN, le complément de A (adénine) est l'uracile au lieu de la thymine :
| purine | pyrimidine |
|---|---|
| A | U |
| G | C |
Synthèse des pyrimidines
La plupart des organismes vivants sont capables de synthétiser naturellement des pyrimidines. On ne connait aujourd'hui qu'une voie de biosynthèse commune ; cette voie part de l'aspartate qui est transformée par trois réactions consécutives en orotate (elle-même une pyrimidine), qui devient ensuite de l'UMP après deux réactions supplémentaires. Les autres nucléotides pyrimidiques peuvent ensuite être créés à partir de l'UMP.
Chez l'homme, la synthèse des pyrimidines se produit dans le cytoplasme des cellules, et surtout dans celles du foie, ou alors dans les cellules du cerveau mais dans une moindre mesure. Cette voie de biosynthèse est la cible de nombreux inhibiteurs pharmacologiques.
Les pyrimidines peuvent être obtenues synthétiquement par réaction entre un dérivé β-dicarbonylé (ex. : β-dicétone) et une amidine (ou un composé identique tel l'urée, la thiourée ou la guanidine) avec catalyse acide ou basique si les combinaisons de nucléophile-électrophile ne sont pas suffisament réactives. Certaines de ces combinaisons peuvent conduire à la formation de pyrimidones, analogues des pyridones.
Une voie de synthèse intéressante des méthylpyrimidines est l'addition de l'amidure de sodium sur la 2-bromopyridine. Tandis que les conditions sont identiques à la réaction de Chichibabin, on a addition en position 4, ouverture de cycle avec élimination du bromure, réarrangement et fermeture de cycle pour donner la 4-méthylpyrimidine, avec un rendement de 80%. Appliquée à la 2-bromopyrimidine, cette réaction mène à une 1, 3, 5-triazine. Cependant, la 2, 6-dibromopyridine, traitée dans les mêmes conditions, ne donne pas de triazine comme on pourrait l'imaginer mais à un diazole, par contraction de cycle.
Dimère
Dans l'ADN, quand deux bases pyrimidiques (la cytosine ou la thymine) sont empilées consécutivement sur le même brin, elles peuvent réagir sous l'effet des rayons uv pour former un dimère covalent. Ce dimère de pyrimidine se forme par cycloaddition sur les doubles liaisons entre les carbones 5 et 6. Il se forme un cycle cyclobutane entre les deux bases consécutives.
Cette modification photochimique induit une déformation et une rigidification de la double-hélice d'ADN, qui interfère avec la réplication. Ce mécanisme peut induire des mutations dans les cellules exposées et forme la base du pouvoir cancérogène du rayonnement UV. L'ensemble des cellules vivantes disposent d'un mécanisme de réparation spécifique de cette lésion, basé sur des enzymes nommées photolyases.
Réactivité chimique
Les dérivés pyrimidines ne sont pas particulièrement réactifs vis-à-vis de la substitution électrophile dû à leur forte acidité. Une alternative est l'utilisation des N-oxydes ou des pyrimidones induisant un caractère nucléophile au cycle par délocalisation d'électrons π entre N-O ou C-O.
A contrario, les pyrimidines sont propices aux substitutions nucléophiles par délocalisation de la charge sur les atomes d'azotes avec une prédilection pour le carbone en position 2.
Voir aussi
- Pyridine
- Diazines : molécules aromatiques avec deux atomes d'azote dans l'anneau
- Pyrimidine
- Pyridazine
- Pyrazine
- Triazines : molécules aromatiques avec trois atomes d'azote dans l'anneau
- 1, 2, 3-Triazine
- 1, 2, 4-Triazine
- 1, 3, 5-Triazine
Références
- ↑ «Pyrimidine» dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
Recherche sur Google Images : |
|
"File:Pyrimidine structure.png" L'image ci-contre est extraite du site commons.wikimedia.org Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (590 x 658 - 2 ko - png)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité