Hydrogène
L'hydrogène est un élément chimique de symbole H et de numéro atomique 1.
Recherche sur Google Images :

Source image : futura-sciences.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- Combiné avec de l'hydrogène; Qui contient de l'hydrogène (source : fr.wiktionary)
- Élément le plus simple et le plus abondant de l'Univers, son symbole est H. La fusion nucléaire de l'hydrogène en hélium est la... (source : astro-rennes)
L'hydrogène est un élément chimique de symbole H et de numéro atomique 1.
Dans le langage familier, on nomme «hydrogène» le gaz de formule chimique H2 qui s'appelle en toute rigueur dihydrogène. Pour les propriétés relatives à ce gaz (propriétés chimiques, production industrielle, stockage…) voir l'article dihydrogène.
L'hydrogène est le principal constituant du Soleil et de la majorité des étoiles, dont l'énergie provient de réactions de fusion thermonucléaire de l'hydrogène.
Le nom hydrogène vient du grec ὕδωρ (hudôr), «eau» et γεννᾰν (gennen), «engendrer». Ce nom lui a été donné par Lavoisier qui rebaptise ainsi l'«air inflammable» mis en évidence par Cavendish en 1766.
L'hydrogène est l'élément chimique le plus simple ; son isotope le plus commun est constitué uniquement d'un proton et d'un électron. L'hydrogène est ainsi le plus léger atome existant. Comme il ne possède qu'un électron, il ne peut former qu'une liaison covalente : c'est un atome univalent.
Étonnamment, l'hydrogène est un métal : quand il est sous forme solide (très haute pression et particulièrement basse température), il cristallise avec une liaison métallique (voir hydrogène métallique). Dans le tableau périodique des éléments, il est d'ailleurs dans la colonne des métaux alcalins. N'étant pas présent à l'état solide sur Terre, il n'est cependant pas reconnu comme un métal en chimie. De façon simpliste, sa nature métallique est due à son électron périphérique sur son unique et dernière couche saturée à deux électrons.
L'hydrogène est l'élément le plus abondant de l'Univers : 75 % en masse et 92 % en nombre d'atomes. Il est présent en grande quantité dans les étoiles et les planètes gazeuses.
Dans la croûte terrestre, l'hydrogène ne représente que 0, 22 % des atomes, loin derrière l'oxygène (47 %) et le silicium (27 %) [1]. Il est rare aussi dans l'atmosphère terrestre, puisque le dihydrogène ne représente en volume que 0, 55 ppm des gaz atmosphériques. Sur Terre, la source la plus commune d'hydrogène est l'eau dont la molécule est constituée de deux atomes d'hydrogène et d'un atome d'oxygène ; l'hydrogène est en particulier le principal constituant (en nombre d'atomes) de toute matière vivante, dans la mesure où il est présent, associé au carbone dans l'ensemble des composés organiques. par exemple, l'hydrogène représente 63 % des atomes du corps humain[1].
Sous des particulièrement faibles pressions, comme celles qui existent dans l'espace, l'hydrogène a tendance à exister sous forme d'atomes individuels, simplement parce qu'il est alors improbable qu'ils entrent en collision pour se combiner. Les nuages de dihydrogène sont à la base du processus de la formation des étoiles.
Fusion nucléaire de l'hydrogène
L'hydrogène présent en grandes quantités dans le cœur des étoiles est une source d'énergie via les réactions de fusion nucléaire qui combinent quatre atomes d'hydrogène pour former un atome d'hélium. Les deux voies de cette fusion nucléaire naturelle sont le cycle carbone-azote-oxygène catalytique de Bethe et von Weizsäcker et la chaîne proton-proton.
La fusion nucléaire de l'hydrogène est aussi la source d'énergie principale dans les bombes à hydrogène ou bombes H.
Composés chimiques de l'hydrogène
L'atome d'hydrogène peut engager son unique électron pour former une liaison covalente avec de nombreux atomes non-métalliques.
Les composés les plus connus sont :
- la molécule de dihydrogène H2 ;
- la molécule d'eau H2O ;
- les molécyles d'hydrocarbures CxHy.
L'hydrogène est aussi présent dans l'ensemble des molécules organiques, où il est lié essentiellement à des atomes de carbone, d'oxygène et d'azote.
L'atome d'hydrogène peut perdre son unique électron pour donner l'ion hydrogène H+.
On le sert à désigner alors fréquemment par le nom de proton, étant donné qu'en perdant son électron l'atome est réduit à son noyau, et que dans le cas de l'isotope le plus abondant 1H ce noyau n'est constitué que d'un proton. Cette appellation n'est pas rigoureusement correcte si on tient compte de la présence, certes discrète (inférieure à 0, 02 %), des autres isotopes…
Son rayon est particulièrement petit : à peu près 1, 5×10−15 m contre 5×10−11 m pour l'atome.
Il n'existe pas à l'état libre mais est toujours lié au nuage électronique d'une molécule. En solution aqueuse (telle H2O) il est solvaté par des molécules d'eau ; on peut en simplifiant considérer qu'il est capté par une molécule d'eau, formant un ion oxonium H3O+.
L'hydrogène se combine avec la majorité des autres éléments car il possède une électronégativité moyenne (2, 2) et peut ainsi former des composés avec des éléments métalliques ou non-métalliques. Les composés qu'il forme avec les métaux sont nommés hydrures dans lesquels il se trouve sous forme d'ions H− qui quelquefois n'existent qu'en solution. Dans les composés avec les non-métalliques, l'hydrogène forme des liaisons covalentes, car l'ion H+, qui n'est rien d'autre qu'un simple proton, a une trop forte tendance à s'associer avec les électrons. Dans les acides en solution aqueuse, il se forme des ions H3O+, association du proton et d'une molécule d'eau.
L'hydrogène joue un rôle essentiel dans une réaction acido-basique (au sens de la théorie de Bronsted-Lowry) puisque cette dernière correspond formellement à l'échange d'un ion hydrogène H+ entre deux espèces, la première (l'acide) libérant H+ par rupture d'une liaison covalente, et la seconde (la base) captant cet H+ par formation d'une nouvelle liaison covalente :
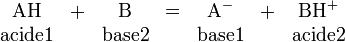
La liaison hydrogène est une interaction électrostatique entre l'hydrogène lié chimiquement à un atome électronégatif A et un autre atome électronégatif B (A et B étant typiquement O, N ou F en chimie organique).
Cette liaison joue un rôle important en chimie organique, puisque les atomes d'oxygène O, d'azote N ou de fluor F sont susceptibles de créer des liaisons hydrogène, mais également en chimie inorganique, entre les alcools et les alkoxydes métalliques.
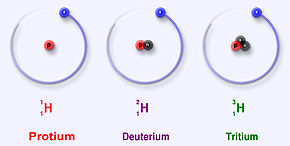
L'hydrogène est l'unique élément dont chaque isotope porte un nom spécifique, car leur différence de masse assez à l'hydrogène est significative : du simple au double ou au triple, ce qui explique que, au contraire de ce qui vaut pour les isotopes généralement, ces différences peuvent influencer les propriétés chimiques du deutérium ou du tritium comparé au protium (effet isotopique). L'eau lourde (D2O) est par exemple toxique (à forte dose) pour de nombreuses espèces : à cause de la grande différence de masse entre les isotopes la cinétique des réactions en solution aqueuse «lourde» est énormément ralentie…
Les isotopes connus de l'hydrogène sont :
- l'hydrogène léger ou protium (1H) ) ; c'est le plus abondant (∼99, 98 %). Simplement constitué d'un proton et ne possèdant par conséquent pas de neutron, c'est un isotope stable.
- le deutérium (2H ou D) ; nettement moins abondant (∼0, 015 % en moyenne ; de 0, 0184 à 0, 0082 % de l'hydrogène naturel), il possède un proton et un neutron et c'est un isotope stable.
- le tritium (3H ou T) ; Constitué d'un proton et de deux neutrons, il n'est présent qu'en infime quantité (un atome de tritium pour 1018 atomes d'hydrogène). Instable, c'est l'unique isotope radioactif de l'hydrogène, dont il possède semble-t-il les mêmes propriétés chimiques et physiques si ce n'est qu'il se transforme en 3He par émission d'un électron (radioactivité β−). 2H et 3H peuvent participer à des réactions de fusion nucléaire…
Sa radiotoxicité est connue particulièrement faible quand il est présent sous forme HTO (eau tritiée), elle est moins connue ainsi qu'à ce jour moins bien comprise quand elle est émise par une forme organique (les études présentent des résultats contradictoires ou particulièrement variables selon leurs protocoles expérimentaux) [2]. Dans l'environnement, le tritium peut prendre la place de l'hydrogène dans l'ensemble des molécules où il est présent, y compris dans les molécules «biologiques» et jusque dans l'ADN où il peut être cause de cassure de l'ADN, de mutations ou d'apoptoses cellulaires. Le tritium est un élément rare ce qui explique une concentration de l'eau ou des tissus le plus souvent particulièrement faible (hors contaminations accidentelles liées à une source anthropique de tritium). - le quaternium ou le tétradium (4H ou Q) est l'isotope le plus instable de l'hydrogène à émission de neutron. [3] Sa demi-vie est particulièrement courte : 1, 39 × 10−22 secondes[4]
- l'hydrogène 7, l'isotope le plus riche en neutrons jamais observé. Sa demi-vie est de l'ordre de 10−21 secondes. [5].
L'atome d'hydrogène est l'atome le plus simple qui existe. C'est par conséquent celui pour lequel la résolution de l'équation de Schrödinger, en physique quantique, est la plus simple. L'étude de ce cas est essentiel, dans la mesure où il a permis d'expliquer les différentes liaisons chimiques, avec la théorie des orbitales moléculaires et la théorie VSEPR.
- ↑ a b p. 6 Reginald H. Garrett, Charles M. Grisham, B. Lubochinsky, Biochimie, De Bœck Université, 2000, 1292 p. (ISBN 2744500208)
- ↑ Fiche radiotoxicologique «tritium» du CEA, version 12-2005, rédigée par Annabelle Comte
- ↑ Hydrogen-4 and Hydrogen-5 from t+t and t+d transfer reactions studied with a 57.5-MeV triton beam, G. M. Ter-Akopian et al., Nuclear Physics in the 21st Century : Mondial Nuclear Physics Conference INPC 2001, American Institute of Physics Conference Proceedings 610, pp. 920-924, DOI :10.1063/1.1470062.
- ↑ p. 27, The NUBASE evaluation of nuclear and decay properties, G. Audi, O. Bersillon, J. Blachot, and A. H. Wapstra, Nuclear Physics A 729 (2003), pp. 3 ;128.
- ↑ [pdf] Communiqué de presse Découverte de l'hydrogène 7, le dispositif nucléaire le plus exotique jamais observé. – 19 novembre 2007
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité