Nicotinamide adénine dinucléotide
Le Nicotinamide adénine dinucléotide abrégé en NAD est une cœnzyme d'oxydoréduction présent dans l'ensemble des cellules vivantes.
| Nicotinamide adénine dinucléotide | |
|---|---|
 |
|
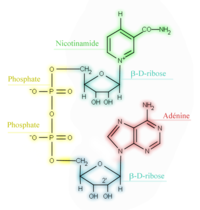
| Figure 1 : La forme oxydée du nicotinamide adénine dinucléotide (NAD+) | |
| Général | |
| Synonymes | NAD+ Cœnzyme I |
| No CAS | |
| No EINECS | |
| DrugBank | |
| SMILES |
|
| InChI |
|
| Apparence | solide |
| Propriétés chimiques | |
| Formule brute | C21H27N7O14P2 |
| Masse molaire | 663, 4251 g∙mol-1 C 38, 02 %, H 4, 1 %, N 14, 78 %, O 33, 76 %, P 9, 34 %, |
| Écotoxicologie | |
| DL50 | 4333mg/kg (souris, i. p. ) [1] |
|
|
|
Le Nicotinamide adénine dinucléotide abrégé en NAD est une
Structure
Le NAD est dérivé de la vitamine B3 (ou vitamine PP) : la nicotinamide.
La figure 1 présente la structure du NAD+ (forme oxydée). Ce cœnzyme n'est pas fixé sur l'apœnzyme, c'est un cosubstrat.
Mode d'action
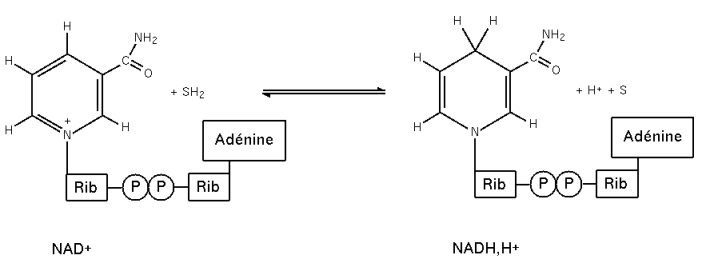
Le cœnzyme fixe réversiblement un ion H+ et un électron sur le noyau nicotinamide (figure 2) en présence d'une enzyme de la classe des
Le couple oxydant/réducteur est le suivant : 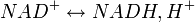
Intérêt en biochimie analytique
Il réside dans une propriété physique spécifique : le NAD+ possède un maximum d'absorption en ultraviolet à 260 nm ; la forme réduite (NADH) quant à elle possède deux maxima d'absorption en UV, un premier à 260 nm et un second à 340 nm. En suivant l'absorbance à 340 nm, on pourra suivre l'évolution de la réaction enzymatique, une augmentation d'absorbance indiquant une formation de NADH (la réaction va dans le sens de la réduction du substrat) tandis qu'une diminution d'absorbance indique la consommation de NADH, par conséquent une formation de NAD+ (la réaction va dans le sens de l'oxydation du substrat). La courbe  correspond à la cinétique d'apparition ou de disparition du NADH. A partir de cette courbe, il est envisageable de calculer la vitesse d'origine de la réaction (voir Équation de Michælis Menten).
correspond à la cinétique d'apparition ou de disparition du NADH. A partir de cette courbe, il est envisageable de calculer la vitesse d'origine de la réaction (voir Équation de Michælis Menten).
Le cœfficient d'extinction molaire de la forme réduite (NADH) à 340 nm = 6, 22 103 mol-1. L. cm-1
Rôle dans le métabolisme
Le NAD est une
Notes et références
- ↑ (en) «Nadide» sur ChemIDplus, consulté le 16 août 2009
Voir aussi
Recherche sur Google Images : |
|
"du Nicotinamide adénine" L'image ci-contre est extraite du site fr.wikipedia.org Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (570 x 311 - 9 ko - png)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité