ADN topoïsomérase
Les ADN topoïsomérases sont des enzymes qui contrôlent la structure topologique de l'ADN en générant des coupures transitoires dans ce dernier et en catalysant le passage des segments d'ADN à travers ces coupures avant de les refermer.
Les ADN topoïsomérases (de type I : ADN topo-isomérases et de type II : ADN gyrases) sont des enzymes qui contrôlent la structure topologique de l'ADN en générant des coupures transitoires dans ce dernier et en catalysant le passage des segments d'ADN à travers ces coupures avant de les refermer. Elles permettent surtout d'ajouter et d'enlever des supertours dans les molécules d'ADN. Elles jouent un rôle essentiel lors de nombreuses étapes de la vie cellulaire (réplication, transcription, séparation des chromosomes, etc. ).
Ces enzymes sont aujourd'hui l'objet d'une activité de recherche intense, surtout parce qu'elles sont les cibles pharmacologiques d'importants agents anticancéreux.
Historique
En 1970, James Wang découvre une nouvelle classe d'enzyme, les ADN topoisomérase|topoisomérases. Ces enzymes ont la possibilité de changer la topologie de la molécule d'ADN en contrôlant la torsion et l'enroulement des deux brins de la molécule pour permettre le déroulement des processus de la cellule. Elles sont par conséquent capitales dans la réplication, la transcription et la recombinaison de l'ADN. Elles sont aussi essentielles pour détacher les molécules d'ADN et permettre la séparation des chromosomes dupliqués à la mitose.
Classes
Il existe deux classes de topoisomérases dépendant de leur structure et du mécanisme qu'elles adoptent sur la topologie de l'ADN : la topoisomérase de type I, divisée en type IA et IB et la topoisomérase de type II.
La topoisomérase de type II est caractérisée par ses sous-unités d'homodimère qui est rapportée à deux isœnzymes : alpha et bêta. De plus, la topoisomérase II est magnésium- et ATP-dépendante. Elle a un poids moléculaire de 170-180 kDa et sa fixation à l'ADN est au 5' (pour comparaison, la topoisomérase de type IA est magnésium-dépendant, a un poids de 100 à 110 kDa et le type IB n'a aucune dépendance, a un poids de 70 à 92 kDa et une fixation à l'ADN au 3'). La topoisomérase de type I agit en monomère au contraire de la topoisomérase de type II.
Les ADN-topoisomérases de type I et II sont présentes dans l'ensemble des cellules eucaryotes et procaryotes. Ces enzymes résolvent les problèmes topologiques dans l'ensemble des aspects du métabolisme de l'ADN. Cette caractéristique leur donne un rôle indispensable à la vie cellulaire.
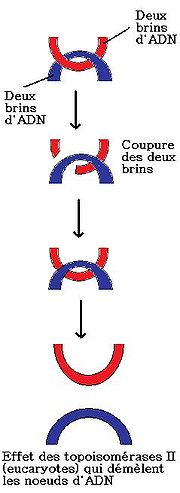
La topoisomérase de type II effectue une coupure temporaire dans la molécule d'ADN pour y faire passer les deux brins de la double hélice (au contraire de la topoisomérase de type I qui n'en fait passer qu'un).
Mécanisme d'action
Toutes les topoïsomérases identifiées utilisent un résidu tyrosine pour cliver la liaison phosphodiester de l'ADN. Selon leur mode de coupure, elles sont classées en deux groupes : les ADN topoïsomérases de type I (monomériques et , outre la reverse gyrase, ATP- indépendantes), qui coupent un seul des deux brins de la double hélice de l'ADN ; et les ADN topoïsomérases de type II (multimériques et ATP-dépendantes), qui exécutent une coupure double-brin de l'ADN. Ces dernières ont une importance spécifique dans la séparation des chromosomes durant l'anaphase. Parmi elles, la gyrase est capable d'introduire dans l'ADN des supertours négatifs.
Son mécanisme d'action autorise la molécule d'ADN de se relâcher, de produire des super hélices et de faire ou défaire des nœuds. La topoisomérase II va venir se fixer à l'aide du magnésium pour que l'enzyme puisse s'accrocher aux doubles brins de l'ADN et celle-ci va changer de conformation en se fixant au segment d'ADN. Par la suite, deux molécules d'ATP sont principales afin d'effectuer une coupure sur l'un des deux segments et d'en faire passer la seconde. En effet, la captation de l'ATP amène un changement conformationel du domaine N-terminal des monomères, entraînant la prise du double brin d'ADN. On peut constater une libération du segment d'ADN quand les deux extrémités du premier segment d'ADN se rejoignent avec une ligase.
Le processus de coupure-refermeture de l'ADN correspond à une réaction de transestérification réversible catalysée par le groupement OH d'une tyrosine appartenant au site actif.
Anti-topoisomérases II
Les topoisomérases de type II sont indispensables à la vie cellulaire : présentes partout dans l'organisme, elles sont d'excellentes cibles d'agent médicamenteux. Les inhibiteurs de la topoisomérase II empêchent la séparation de l'enzyme et de l'ADN puis créent des complexes de clivage.
Les inhibiteurs peuvent agir au niveau de la bactérie en ciblant l'ADN gyrase qui est membre de la famille des topoisomérases de type II. Cette action va inhiber la gyrase et va par conséquent empêcher la multiplication bactérienne. Ces antibiotiques sont fréquemment utilisés dans les infections urinaires (ex. : norfloxacine).
Les topoisomérases sont aussi la cible de plusieurs médicaments anticancéreux, qui augmentent les complexes de clivages pour aboutir à l'apoptose de la cellule. Deux produits dérivés de la podophyllotoxine dominent cette classe thérapeutique :
- Le VP-16 (étoposide), un des médicaments les plus utilisés en chimiothérapie cancérologique.
- Le ténoposide, en particulier utilisé pour le traitement des lymphomes.
L'action de ces inhibiteurs est assez sélective car les cellules tumorales ont énormément de topoisomérases. Cependant, ces médicaments entraînent de nombreux effets secondaires, dont quelquefois des leucémies. En effet, les agents chimiothérapeutiques détruisent les cellules en prolifération rapide, par conséquent affectent largement le nombre de globules blancs.
Aujourd'hui, les inhibiteurs de topoisomérases utilisés comme antitumoraux ont peu de spécificité d'action, ce qui leur confère de nombreux effets secondaires dus aux coupures qu'ils produisent partout sur l'ADN. Les topoisomérases II sont en effet les mêmes dans l'ensemble des cellules du corps. C'est d'ailleurs le problème universel de la chimiothérapie. On essaie d'inhiber des enzymes impliquées dans le cancer mais qui se retrouvent partout ailleurs dans les autres cellules.
Les recherches actuelles visent à augmenter la spécificité d'action de ces inhibiteurs en ciblant les gènes impliqués dans le cancer. En créant des coupures spécifiques sur ces molécules bicaténaires, on élimine l'information donnant la possibilité le développement et le maintien de la maladie.
Inhibiteurs
De nombreuses molécules sont utilisées en chimiothérapie anticancéreuse :
- des molécules inhibitrices des topoïsomérases I : le topotécan, l'irinotécan ;
- des molécules inhibitrices des topoïsomérases II : l'étoposide.
Sources
- Garrett, Grisham, Biochimie, DeBœck Université, Paris, 2000
- Karp, Biologie cellulaire et moléculaire, DeBœck, 2ième édition, Bruxelles, 2004
- Griffiths, Miller, Introduction à l'analyse génétique, DeBœck, 3ième édition, Paris, 2002
- Bibliothèque pour la science, Des gènes aux protéines, Pour la science S. A. R. L., Librairie Belin, Paris, 1984
- Strick, T., Croquette, V et Bensimon D. Single-molecule analysis of DNA uncoiling by a type II topoisomerase. Nature (2000)
- [1] Topoisomérases sur http ://jeanfrancois. riou. free. fr
- [2] Dossier sur www. ulb. ac. be
- [3] Cours sur www. google. ca/books
- [4] Cours sur www. baclesse. fr
- [5] Biologie moléculaire sur http ://spiral. univ-lyon1. fr
Recherche sur Google Images : |
|
"l'ADN topoisomérase II" L'image ci-contre est extraite du site lbpa.ens-cachan.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (374 x 356 - 37 ko - )Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité